最近發(fā)表
產(chǎn)品中心
Copyright ? 2025 廣州達博生物制品有限公司
由黃文林教授領(lǐng)銜的廣州達博生物制品有限公司研發(fā)的國家I類新藥——自體自然殺傷細胞注射液(E10H)于2022年11月28日順利完成I期臨床試驗首例受試者入組。
10月11日,廣州達博生物制品有限公司自主研發(fā)的治療用生物制品1類新藥“評估E10H在晚期消化道癌患者中安全性與耐受性的I期臨床研究”項目啟動會以線上形式圓滿開展。

5月11日,廣州達博生物制品有限公司開發(fā)的治療用生物制品1類新藥——E10B項目Ⅰ期臨床試驗啟動會以線上形式在廣州、蚌埠兩地同時舉行。
近日,由廣州達博生物制品有限公司自主研發(fā)的細胞免疫治療創(chuàng)新藥物E10H:自體自然殺傷細胞注射液(Autologous Natural Killer Cell Injection)獲得國家藥監(jiān)局批準進入臨床試驗(批件號:2022LP00160)。
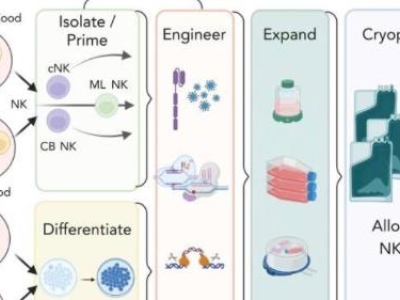
2021年11月23日,E10H申請境內(nèi)生產(chǎn)藥品注冊臨床試驗獲得國家藥品監(jiān)督管理局受理。本品屬于全新治療用生物制品,按照注冊分類1類申報1期臨床試驗。
隨著生物醫(yī)藥行業(yè)的快速發(fā)展,越來越多的生物制品開始服務(wù)于人類健康,同時各國對生物制品的質(zhì)量監(jiān)管也越來越嚴格,其中宿主核酸的殘留就是監(jiān)管的重要一項。殘留的宿主核酸可能帶來傳染性或者致瘤風險,因此WHO及

7月13日,廣州達博生物制品有限公司與 廣州博濟醫(yī)藥生物技術(shù)股份有限公司(下稱博濟醫(yī)藥)在達博生物公司總部順利舉行 E10B Ⅰ期臨床研究簽約儀式。E10B為治療用生物制品1類新藥,由達博生物研制開發(fā)

2021年5月19日,達博生物自研創(chuàng)新藥——E10B獲得國家藥品監(jiān)督管理局的I期臨床試驗批件。