當(dāng)前招募項(xiàng)目

E10I干細(xì)胞治療2型糖尿病安全性、耐受性以及初步有效性的I期臨床研究
目標(biāo)人群:在飲食和運(yùn)動(dòng)基礎(chǔ)上,經(jīng)標(biāo)準(zhǔn)治療后血糖仍控制不佳的難治型2型糖尿病患者
適應(yīng)癥
- 2型糖尿病
基本入選標(biāo)準(zhǔn):
- 1.年齡18-80周歲。
- 2.根據(jù)1999年WHO糖尿病診斷標(biāo)準(zhǔn),確診為2型糖尿病患者,且病程≥10年
- 3.女性受試者體重≥45kg,男性受試者體重≥50kg,且18.5 kg/m2≤BMI≤28.0 kg/m2.
- 4.篩選時(shí),已根據(jù)中國(guó)糖尿病防治指南(2024版)的要求,進(jìn)行飲食和運(yùn)動(dòng)控制,使用至少3種口服降糖藥或者胰島素聯(lián)合至少2種口服降糖藥(口服藥劑量為標(biāo)準(zhǔn)劑量或者最大耐受量,治療時(shí)長(zhǎng)至少3個(gè)月),血糖控制不佳(HbA1c≥7.5%)。
- 5.篩選時(shí),空腹C肽<1.2 nmol/L
- 6.育齡期女性患者妊娠試驗(yàn)為陰性,同時(shí)愿意在研究期間及研究結(jié)束后6個(gè)月使用可靠的生育控制方法(避孕藥除外)。未接受過絕育手術(shù)的男性須同意在研究期間及研究結(jié)束后6個(gè)月采用有效避孕措施。
- 7.充分了解本試驗(yàn)的目的和要求,愿意在研究期間按照中國(guó)糖尿病防治指南(2024版)的要求,進(jìn)行飲食和運(yùn)動(dòng)控制。自愿參加并簽署書面知情同意書,能按試驗(yàn)要求完成。
排除標(biāo)準(zhǔn):
- 1.年齡18-80周歲。
- 1、診斷為1型糖尿病,或特殊類型糖尿病
- 2、急性或慢性胰腺炎。
- 3、嚴(yán)重過敏體質(zhì)、或?qū)λ幬镏械娜魏纬煞郑ㄈ缛搜椎鞍住⒂倚囚⒍谆鶃嗧康龋┻^敏;
- 4、篩選前接受過其他干細(xì)胞治療的患者。
- 5、給藥前4周內(nèi)入組參加了其它治療性臨床試驗(yàn)。
- 6、篩選時(shí)存在糖尿病急性并發(fā)癥如酮癥酸中毒(DKA)、高血糖高滲狀態(tài)(HHS)、或乳酸性酸中毒病史等,或出現(xiàn)嚴(yán)重糖尿病并發(fā)癥,如視網(wǎng)膜病變進(jìn)入增殖期、神經(jīng)病變有痛性神經(jīng)病變、血管病變阻塞程度超過50%等;
- 7、篩選前6個(gè)月內(nèi)曾出現(xiàn)重度低血糖事件或反復(fù)發(fā)生低血糖事件(一周內(nèi)低血糖事件[不包括可能的癥狀性低血糖]≥3次,或一周內(nèi)檢測(cè)到至少3次血糖值<3.0 mmol/L [<54 mg/dL],或經(jīng)研究者判斷的其他低血糖事件)。
- 8、患有嚴(yán)重全身性疾病(如中樞神經(jīng)系統(tǒng)、心血管系統(tǒng)、血液系統(tǒng)、消化系統(tǒng)、內(nèi)分泌系統(tǒng)、呼吸系統(tǒng)、泌尿生殖系統(tǒng)、免疫系統(tǒng)、精神病等)的患者;
- 9、任何未被視為治愈的惡性腫瘤(皮膚基底細(xì)胞癌、鱗狀細(xì)胞癌和甲狀腺微小乳頭狀癌除外); 注:如果過去5 年無癌癥復(fù)發(fā)證據(jù),則視為已治愈。
- 10、患有其他未經(jīng)控制或治療的內(nèi)分泌疾病、代謝疾病或慢性疾病。
- 11、篩選時(shí)凝血功能檢查指標(biāo)符合以下標(biāo)準(zhǔn):INR≥1.3(未使用抗凝劑)。
- 12、篩選時(shí)具有以下實(shí)驗(yàn)室檢查結(jié)果:空腹葡萄糖>15.0mmol/L;谷丙轉(zhuǎn)氨酶(ALT)或天門冬氨酸氨基轉(zhuǎn)移酶(AST)>1.5×正常值上限(ULN);總膽紅素>1.5×ULN;淀粉酶/脂肪酶>1.5×ULN;肌酐清除率估計(jì)值<60 mL/min(通過Cockroft-Gault公式予以估計(jì));
- 13、患有心腦血管疾病,定義為:篩選前6個(gè)月內(nèi)出現(xiàn)充血性心臟衰竭(NYHA III-IV級(jí))、不穩(wěn)定型心絞痛、腦卒中、心肌梗死、冠脈血運(yùn)重建術(shù);和/或篩選時(shí)計(jì)劃接受冠狀動(dòng)脈、頸動(dòng)脈或外周動(dòng)脈血運(yùn)重建術(shù)。
- 14、篩選時(shí)存在未得到控制的嚴(yán)重高血壓(收縮壓≥160 mmHg或舒張壓≥100 mmHg)或低血壓(收縮壓<90 mmHg)。
- 15、篩選時(shí)心電圖檢查結(jié)果存在如下情況者:①顯示具有臨床意義的異常,如室上性心動(dòng)過速、心房顫動(dòng)、心房撲動(dòng)、二度或三度房室傳導(dǎo)阻滯等,且研究者認(rèn)為不適合加入本研究的。②檢查結(jié)果提示ECG QTcF >450 ms(通過Fridericia公式校正的QT間期(QTcF)(女性>480ms))。
- 16、篩選前6個(gè)月內(nèi)有如下情況者:血栓性或栓塞性靜脈或動(dòng)脈事件,如腦血管意外,包括一過性腦缺血發(fā)作、中風(fēng)、動(dòng)脈血栓形成、深靜脈血栓形成和肺栓塞等。
- 17、任何會(huì)對(duì)患者造成風(fēng)險(xiǎn)的急性或慢性感染性疾病;
- 18、篩選時(shí)如患有嚴(yán)重的未得到控制的肺部疾病,包括肺纖維化、間質(zhì)性肺病、慢性阻塞性肺疾病急性加重期、肺部活動(dòng)性感染等。
- 19、首次給藥前12周內(nèi)有獻(xiàn)全血或失血≥400 mL者;
- 20、篩選時(shí),乙型肝炎病毒表面抗原[HBsAg]陽性(乙型肝炎病毒[HBV]脫氧核糖核酸[DNA]定量檢測(cè)結(jié)果低于檢測(cè)參考范圍下限者除外)、或丙型肝炎病毒[HCV]抗體陽性、或人類免疫缺陷病毒[HIV]抗體、或梅毒抗體陽性者
- 21、研究前24周內(nèi)服用免疫抑制藥物(如硫唑嘌呤、甲氨蝶呤)的患者;
- 22、篩選前24周內(nèi)有藥物濫用史者;
- 23、嗜煙、酗酒者(每日吸煙多于10支者;每周飲用14個(gè)單位的酒精:1單位=啤酒360mL,或酒精量為40%的烈酒45mL,或葡萄酒150mL);
- 24、研究者認(rèn)為由于各種原因不適合參加本臨床試驗(yàn)的患者。
E10I

聯(lián)系方式:15992025497
立即申請(qǐng)

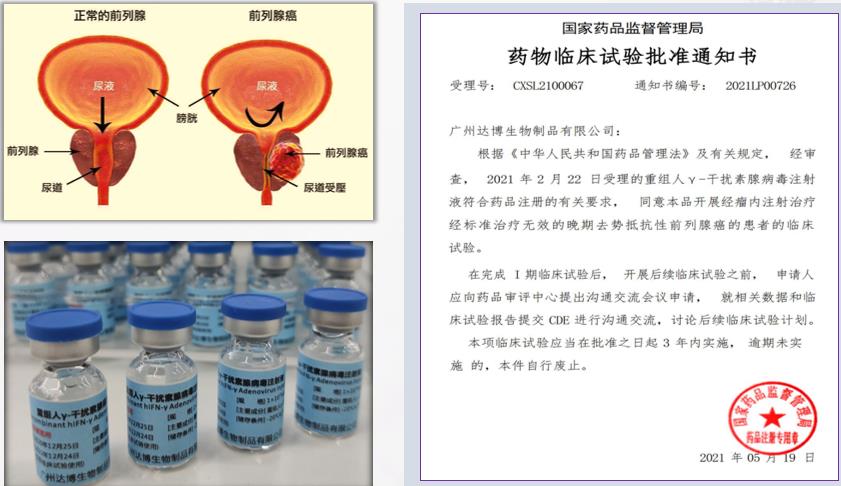
E10B在晚期去勢(shì)抵抗性前列腺癌患者中多次給藥的安全性、耐受性和初步療效的I期臨床研究
您好!我們正在進(jìn)行一項(xiàng)名為E10B在晚期去勢(shì)抵抗性前列腺癌患者中多次給藥的安全性、耐受性和初步療效的的I期臨床研究,本試驗(yàn)由廣州達(dá)博生物制品有限公司申辦,已獲得浙江大學(xué)醫(yī)學(xué)院附屬第一醫(yī)院倫理委員會(huì)批準(zhǔn)并同意,具體招募信息如下
藥物名稱/規(guī)格:
- 名稱:重組人γ-干擾素腺病毒注射液
- 規(guī)格:1.0*10^12VP/支
適應(yīng)癥
- 經(jīng)標(biāo)準(zhǔn)治療失敗的晚期去勢(shì)抵抗性前列腺癌。
基本入選標(biāo)準(zhǔn):
- 18~80歲成年男性患者
- 經(jīng)組織學(xué)證實(shí)的前列腺癌患者
- 根據(jù)病史資料檢查結(jié)果診斷為去勢(shì)抵抗性前列腺癌并經(jīng)標(biāo)準(zhǔn)治療失敗的患者,診斷需 同時(shí)具備以下2個(gè)條件:
- ①血清睪酮達(dá)到去勢(shì)水平(<50ng / dl 或<1.7nmol/L);
- ②生化進(jìn)展:間隔1周或以上連續(xù)3次測(cè)量前列腺特異抗原(PSA)上升,連續(xù)兩次較最低值升高 50%以上,且PSA>2ug/L;或影像學(xué)進(jìn)展:骨掃描發(fā)現(xiàn)2個(gè)或2個(gè)以上的新病灶或符合實(shí)體瘤反應(yīng)評(píng)價(jià)標(biāo)準(zhǔn)的軟組織病灶增大。4)
- 體力狀況:ECOG PS ≤2.5
- 預(yù)計(jì)生存期≥3個(gè)月
E10B
聯(lián)系方式:13572139867
立即申請(qǐng)
關(guān)于我們
參與流程
1
咨詢報(bào)名
通過電話或在線表單咨詢并提交申請(qǐng)
2
初步篩選
研究人員與您聯(lián)系進(jìn)行初步評(píng)估
3
現(xiàn)場(chǎng)評(píng)估
前往研究中心進(jìn)行詳細(xì)檢查和評(píng)估
4
簽署同意書
了解研究詳情后簽署知情同意書
5
參與研究
按照研究方案進(jìn)行治療和隨訪
常見問題
參與臨床研究有哪些好處?
參與臨床研究可能帶來以下好處:
- 獲得最新的治療方案,可能比現(xiàn)有標(biāo)準(zhǔn)治療更有效
- 接受專業(yè)醫(yī)療團(tuán)隊(duì)的密切監(jiān)測(cè)和護(hù)理
- 相關(guān)檢查和治療藥物通常是免費(fèi)的
- 為醫(yī)學(xué)進(jìn)步做出貢獻(xiàn),幫助未來患者
臨床研究有哪些風(fēng)險(xiǎn)?
臨床研究可能存在的風(fēng)險(xiǎn)包括:
- 研究藥物可能引起不良反應(yīng)或副作用
- 研究治療可能不如標(biāo)準(zhǔn)治療有效
- 需要更多次的醫(yī)院訪視和檢查
在您決定參與前,研究人員會(huì)詳細(xì)解釋所有已知風(fēng)險(xiǎn),并采取各種措施最大限度降低風(fēng)險(xiǎn)。
我的個(gè)人信息會(huì)保密嗎?
是的。您的所有個(gè)人信息和醫(yī)療數(shù)據(jù)都將嚴(yán)格保密,僅用于研究目的。研究結(jié)果發(fā)表時(shí)不會(huì)包含任何能識(shí)別您個(gè)人身份的信息。